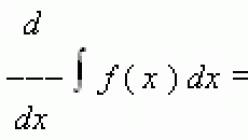Анри Ле Шателье сформулировал принцип, ныне носящий его имя.
Суть принципа: система, находящаяся в состоянии устойчивого химического равновесия, при внешнем воздействии (изменении температуры, давления, концентрации реагирующих веществ и т. п.) стремится вернуться в состояние равновесия, компенсируя оказанное воздействие.
Равновесие будет смещаться до тех пор, пока не наступит новое положение равновесия, которое соответствует новым условиям.
Неоднократно высказывались гипотезы, что принцип Ла Шателье :
- можно рассматривать как вид обратной связи (есть воздействие на систему, и есть её отклик);
- возможно применять не только в области химических реакций, но и в психологии, социологии, экологии и т.п.
На существование отрицательных обратных связей в неживой Природе, вероятно, первым указал Анри Луи Ле-Шателье (1850-1936) - французский ученый в области физической химии и металлов. В 1884 году он сформулировал общий закон смещения химического равновесия в зависимости от внешних факторов, получивший наименование принципа Ле-Шателье. В физико-химических науках существует закон равновесия, сформулированный А. Л. Ле-Шателье. Он говорит о том, что системы, находящиеся в определённом равновесии, обнаруживают тенденцию сохранять его, оказывают внутреннее противодействие силам, его изменяющим. Например, пусть в сосуде находятся в равновесии вода и лёд при О С и нормальном давлении атмосферы. Если сосуд нагревать, то часть льда тает, поглощая теплоту и продолжая таким образом поддерживать прежнюю температуру смеси. Если увеличивать внешнее давление, то часть льда опять-таки превращается в воду, занимающую меньше объёма, что ослабляет повышающееся давление.
Другие жидкости в противоположность воде при замерзании не увеличиваются в объёме, а уменьшаются; они при тех же условиях смеси, при повышающем давлении проявляют обратное изменение: часть жидкости замерзает; давление, очевидно, так же ослабляется этим, как и в предыдущем случае. К растворам, химическим реакциям, движениям тел принцип Ле-Шателье применяется на каждом шагу, позволяя в самых различных случаях предвидеть системные изменения.
Но тот же закон, как показывают многие наблюдения, применим и к находящимся в равновесии системам биологическим, психическим, социальным. Например, человеческое тело на внешнее охлаждение отвечает тем, что усиливает внутренние окислительные и иные процессы, вырабатывающие его теплоту; на перегревание - тем, что повышает процессы испарения, отнимающие теплоту. Нормальная психика, когда в силу внешних условий для неё уменьшается количество ощущений, например когда человек попадает в тюрьму, как бы возмещает этот недостаток, усиливая работу фантазии, а также развивая внимание к мелочам; напротив, при перегрузке впечатлениями понижается внимание, направленное на частности, ослабевает деятельность фантазии и т. п.
Ясно, что вопрос о всеобщности закона Ле-Шателье не может быть поставлен и систематически исследован никакой из специальных наук: физикохимии нет дела до психических систем, биологии - до неорганических, психологии - до материальных. Но с общеорганизационной точки зрения вопрос, очевидно, не только вполне возможен, а совершенно неизбежен.
Богданов А.А. , Тектология: Всеобщая организационная наука в 2-х книгах, Книга 1, М., Экономика, 1989 г., с. 139.
Влияние температуры
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции , при понижении температуры - в направлении экзотермической реакции . В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа:
в системах с газовой фазой - уравнением изохоры Вант-Гоффа
В небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением:
Например, в реакции синтеза аммиака
N 2 + 3H 2 ⇄ 2NH 3 + Q
тепловой эффект в стандартных условиях составляет +92 кДж/моль, реакция экзотермическая, поэтому повышение температуры приводит к смещению равновесия в сторону исходных веществ и уменьшению выхода продукта.
Влияние давления
Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам:
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
В реакции синтеза аммиака количество газов уменьшается вдвое: N 2 + 3H 2 ↔ 2NH 3
Значит, при повышении давления равновесие смещается в сторону образования NH 3 , о чём свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C:
Влияние инертных газов
Введение в реакционную смесь или образование в ходе реакции инертных газов действует так же, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции. В системах с уменьшением количества молей газов инертные газы смещают равновесие в сторону исходных веществ, поэтому в производственных процессах, в которых могут образовываться или накапливаться инертные газы, требуется периодическая продувка газоводов.
Влияние концентрации
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
- При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
- При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Примечания
Wikimedia Foundation . 2010 .
Смотреть что такое "Принцип Ле Шателье" в других словарях:
ПРИНЦИП ЛЕ ШАТЕЛЬЕ - предложенный А. Ле Шателье (1884) и термодинамически обоснованный К. Брауном (1887) принцип, согласно которому внешнее воздействие, выводящее систему из равновесия, стимулирует в ней процессы, стремящиеся ослабить результаты этого воздействия.… … Экологический словарь
ПРИНЦИП ЛЕ ШАТЕЛЬЕ, этот принцип был провозглашен в 1888 г. французским химиком Анри Луи Ле Шателье (1850 1936). Он формулируется следующим образом: если потревожить систему, находящуюся в состоянии РАВНОВЕСИЯ, то система стремится нейтрализовать … Научно-технический энциклопедический словарь
принцип Ле Шателье - см. принцип смещения химического равновесия … Химические термины
Принцип Ле Шателье Брауна (1884 г.) если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы… … Википедия
Принцип Ле Шателье Брауна (1884 г.) если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы уменьшить изменение. Анри… … Википедия
принцип Ле Шателье–Брауна - Le Šateljė ir Brauno principas statusas T sritis chemija apibrėžtis Principas, pagal kurį pusiausviroji sistema, kintant išorės sąlygoms, pati mažina išorės poveikį. atitikmenys: angl. Le Chatellier Braun principle rus. принцип Ле Шателье–Брауна … Chemijos terminų aiškinamasis žodynas
принцип смещения химического равновесия - (принцип Ле Шателье): внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется. Общая химия: учебник / А. В. Жолнин … Химические термины
Анри Луи Ле Шателье Анри Луи Ле Шателье (фр. Henri Louis Le Chatelier; 8 октября 1850, Париж 17 сентября 1936, Мирибель лез Эшель) французский физик и химик. Содержание 1 Биография … Википедия
Анри Луи Ле Шателье фр. Henri Louis Le Chatelier … Википедия
Книги
- Принципы движения экономической системы. Монография , Куснер Юрий Семенович, Царев Игорь Геннадьевич. Представлены в аналитическом виде основные уравнения движения экономической системы и решена задача поиска адекватных методов управления ее движением. Использован математический аппарат,…
Влияние температуры
В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу , а другое - эндотермическому .
N 2 + 3H 2 ⇄ 2NH 3 + Q
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая.
Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам: При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции.
Влияние давления
Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам: При повышении давления равновесие сдвигается в направлении образования веществ (или исходных продуктов) с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом:
N 2 + 3H 2 ↔ 2NH 3
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH 3 , о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400°С:
Влияние концентрации
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
- При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
- При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Примечания
Wikimedia Foundation . 2010 .
Смотреть что такое "Принцип Ле Шателье - Брауна" в других словарях:
Принцип Ле Шателье Брауна (1884 г.) если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в… … Википедия
Принцип Ле Шателье Брауна (1884 г.) если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы уменьшить изменение. Анри… … Википедия
принцип Ле Шателье–Брауна - Le Šateljė ir Brauno principas statusas T sritis chemija apibrėžtis Principas, pagal kurį pusiausviroji sistema, kintant išorės sąlygoms, pati mažina išorės poveikį. atitikmenys: angl. Le Chatellier Braun principle rus. принцип Ле Шателье–Брауна … Chemijos terminų aiškinamasis žodynas
Анри Луи Ле Шателье Анри Луи Ле Шателье (фр. Henri Louis Le Chatelier; 8 октября 1850, Париж 17 сентября 1936, Мирибель лез Эшель) французский физик и химик. Содержание 1 Биография … Википедия
Остается неизменным до тех пор, пока постоянны параметры, при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ.
Процесс перехода системы от одного равновесного состояния к другому называется смещением или сдвигом химического равновесия.
Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций. Равновесие смещается в сторону той реакции, скорость которой при нарушении равновесия становится больше. Например, если при изменении внешних условий равновесие нарушается так, что скорость прямой реакции становится больше скорости обратной реакции (V ® > V ¬), то равновесие смещается вправо.
В общем случае направление смещения равновесия определяется принципом Ле Шателье : если на систему, находящуюся в состоянии равновесия, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Смещение равновесия может быть вызвано:
Изменением температуры;
Изменением концентрации одного из реагентов;
Изменением давления.
Остановимся на влиянии каждого из этих факторов на состояние химического равновесия более подробно.
Изменение температуры. Повышение температуры вызывает увеличение константы скорости эндотермического процесса (DH 0 Т > 0 и DU 0 Т > 0) и уменьшение константы скорости экзотермического процесса (DH 0 Т < 0 и DU 0 Т < 0), следовательно, при повышении температуры равновесие смещается в сторону протекания эндотермической реакции, а при понижении температуры - экзотермической реакции.
Например :
N 2(г) + 3H 2(г) Û 2NH 3(г) DH 0 Т = -92,4 кДж/моль, т.е. прямой процесс экзотермический, следовательно, при увеличении температуры равновесие сместится влево (в сторону протекания обратной реакции).
Изменение концентрации. При увеличении концентрации какого-либо из веществ равновесие смещается в сторону расхода этого вещества, а уменьшение концентрации какого-либо вещества смещает равновесие в сторону его образования.
Например, для реакции 2HCl (г) Û H 2(г) + Cl 2(г) увеличение концентрации хлороводорода приводит к смещению равновесия вправо (в сторону протекания прямой реакции). Этот же результат можно получить при уменьшении концентрации водорода или хлора.
Изменение давления. Если в реакции участвует несколько газообразных веществ, то при повышении давления равновесие смещается в сторону образования меньшего количества молей газообразных веществ в газовой смеси и, соответственно, в сторону уменьшения давления в системе. Наоборот, при понижении давления равновесие смещается в сторону образования большего количества молей газа, что вызывает увеличение давления в системе.
Пример :
N 2(г) + 3H 2(г) Û 2NH 3(г) .
1 моль + 3 моль Û 2 моль
При увеличении давления в системе равновесие данной реакции смещается вправо (в сторону протекания прямой реакции).
Если в прямой и обратной реакциях участвует одинаковое количество молей газообразных веществ, то изменение давления не вызывает смещения химического равновесия.
Катализатор на смещение равновесия влияния не оказывает, он только ускоряет наступление химического равновесия.
Смещение химического равновесия.
Изменение температуры реакции, концентраций реагентов, давления в системе (только для газов) приводят к нарушению равенства , а значит, к нарушению состояния равновесия в системе. Через некоторое время равенство скоростей прямой и обратной реакций снова восстанавливается. Однако, равновесные концентрации в новых условиях реакции принимают новые значения.
Переход системы из одного равновесного состояния в другое называется смещением равновесия.
Смещение равновесия определяется закономерностью, известной под названием принципа Ле-Шателье , т.е. принципа подвижного равновесия: если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то равновесие смещается в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия.
Влияние концентраций реагирующих веществ на состояние равновесия
Увеличение концентрации , или , в соответствии с принципом Ле-Шателье, вызывает сдвиг равновесия вправо, а увеличение концентрации - влево.
Следовательно, увеличение концентраций исходных веществ вызывает смещение химического равновесия в сторону увеличения продуктов реакции, а увеличение концентраций продуктов реакции – в сторону увеличения реагентов.
Влияние давления на состояние химического равновесия
Давление оказывает существенное влияние только на газообразные системы, т.к., только в них возможно большое изменение объема равновесной системы.
При увеличении давления повышаются концентрации реагирующих веществ, а значит, и скорость химической реакции.
При взаимодействии газообразных веществ можно представить три случая.
1. Суммарное число молей исходных веществ равняется суммарному числу молей продуктов реакции.
Если увеличить давление в системе в два раза, то, соответственно, объем уменьшится в два раза, а значит, увеличатся в два раза концентрации газов. Скорости прямой и обратной реакций возрастают, но в равное число раз. Поэтому в этом случае смещения состояния химического равновесия в системе не произойдет.
Следовательно, если объемы исходных и конечных продуктов реакции равны , то изменение давления не нарушает состояние химического равновесия в системе.
2. Суммарное число молей исходных веществ больше
В этом случае суммарные объемы газов, вступающих в реакцию, больше суммарных объемов газообразных продуктов реакции. Таким образом, эта реакция протекает с уменьшением объема.
При повышении давления в системе равновесие смещается в сторону меньшего числа молей, т.е. в сторону образования аммиака.
3. Суммарное число молей исходных веществ меньше , чем суммарное число молей продуктов реакции.
Если при равновесии повысить давление в системе, то эта система окажет противодействие, стремясь к первоначальному состоянию. Химическое равновесие сместится в сторону обратной реакции, сопровождающейся понижением давления. Если при равновесии понизить давление в системе, то равновесие сместится в сторону прямой реакции, приводящей к повышению давления, т.е. возрастет концентрация диоксида азота.
Таким образом, повышение давления сдвигает равновесие в сторону меньших объемов, а понижение давления – в сторону больших объемов.
Влияние температуры на состояние равновесия
В соответствии с принципом Ле-Шателье, повышение температуры в системе вызывает смещение химического равновесия в сторону эндотермического процесса, а уменьшение температуры – в сторону экзотермического процесса.
Значит, необходимо знать тепловой эффект реакции. Направление смещения равновесия определяется знаком теплового эффекта реакции, а степень смещения равновесия – величиной ΔН, т.е. чем больше ΔН, тем сильнее влияние температуры.
Определим, как влияет температура на направление смещения равновесия в системе:
Т.к. прямая реакция – экзотермическая, то при нагревании системы химическое равновесие будет смещаться влево, а при охлаждении – вправо.
При величине ΔН, близкой к нулевому значению, температура практически не влияет на состояние химического равновесия.
Для выбора оптимальных условий протекания химической реакции необходимо учитывать не только влияние на равновесие всех факторов: температуры, давления, концентрации, но и еще их влияние на скорость процессов.
Пример: получение аммиака
Образование аммиака сопровождается уменьшением числа молей, поэтому сместить равновесие вправо можно путем увеличения давления. Поскольку реакция экзотермическая, ее следует проводить при низких температурах. Но ниже 400?С скорость химической реакции очень мала, и состояние равновесия наступает через большой промежуток времени. Следовательно, процесс становится нерентабельным. Поэтому синтез аммиака проводят при повышенном давлении (примерно 30–50МПа) и при температуре 400-500°С. В качестве катализатора используют губчатое железо. Таким образом, экономически выгоднее проводить технологический процесс с меньшим выходом продукта, но за более короткий срок.
Катализатор не влияет на состояние химического равновесия в системе.